 |
| Gambar Model Atom Bohr |
Menurut Borh, model atom Rutherford sudah cukup baik. Untuk
menyempurnakan model atom Rutherford ini Borh punya pandangan sangat
berani dan sangat radikal yaitu
“teori elektromagnetik klasik tidak berlaku pada sistem yang berukuran sangat kecil seperti atom”
Aneh tapi nyata bahwa dengan konsep ini Borh menyelamatkan model atom
Rutherford sehingga Rutherford tidak perlu khawatir elektronnya
kehabisan energi dan jatuh menimpah inti.
Di kalangan ilmuwan, pandangan radikal Borh ini dikenal sebagai dua postulat (dalil) Borh yaitu:
- Berlawanan dengan teori elektromagnetik klasik, dalam suatu sistem atom, elektron tidak memancarkan radiasi ketika ia mengorbit inti atom. Lintasan-lintasan di mana elektron dapat mengorbit tanpa memancarkan radiasi dinamakan lintasan stasioner atau orbit stabil.
- Pemancaran dan penyerapan gelombang elektromagnetik dalam suatu atom berhubungan erat dengan transisi elektron dari dua lintasan stasioner.
Radiasi yang dipancarkan atau yang diserap, mempunyai frekuensi f yang ditentukan oleh rumus
hf = |Ei – Ef|
dengan Ef dan Ei masing-masing menyatakan energi akhir dan energi mula-mula keadaan stasioner dan h merupakan konstanta Planck yang besarnya:
h = 6,6260755 x 10-35 J.s
catatan: pada persamaan di atas kita menggunakan harga mutlak untuk menghindari f negatif. Jika kita tidak ingin menggunakan harga mutlak, kita harus gunakan rumus hf = Ei – Ef untuk pemancaran radiasi (karena energi mula-mula lebih tinggi dari energi akhir) atau rumus hf = Ef – Ei untuk penyerapaka radiasi (energi akhir lebih tinggi dari energi mula-mula).
Dengan menggunakan postulatnya, Bohr berhasil menurunkan rumus untuk
jari-jari lintasan stasionernya dan Borh menurunkan juga rumus spektrum
atom hidrogen dan menerangkan mengapa terjadi spektrum yang demikian!
Inilah yang membuat model atom Borh terkenal.
Rumus jari-jari lintasan stasioner
Anggap suatu elektron bermuatan qe = – e mengorbit suatu ini atom yang bermuatan qi = +Ze. Gaya listrik antara kedua muatan ini diberikan oleh rumus
Dengan k = 9 x 109 Nm2/C2 merupakan konstanta Coulomb dan r adalah jarak pusat elektron ke pusat inti atom.
Jika elektron bergerak dalam suatu orbit stabil melingkar mengelilingi inti dengan jari-jari r dan dengan kelajuan tetap v, maka gaya sentripetalnya sama dengan mv2/r. Karena gaya sentripetal ini diberikan oleh gaya tarik listrik, maka:
Dalam persamaan di ata, hanya r dan v yang merupakan variabel. Untuk menghitung kedua besaran, kita tuliskan persamaan di atas dalam bentuk,
Suku di sebelah kiri merupakan perkalian antara momentum elektron dan jari-jari orbit. Besaran ini dinamakan momentum sudut elektron.
Menurut mekanika Newton (klasik) jari-jari orbit suatu benda dapat mempunyai sembarangan harga. Namun postulat pertama Born menyatakan bahwa hanya orbit tertentu saja yang diijinkan. Postulat Borh dapat dipenuhi jika besaran mvr tidak mengambil sembarang nilai (kita katakan bahwa besaran mvr terkuantisasi atau momentum sudut terkuantisasi), nilai besaran ini ditentukan oleh rumus
Dengan h adalah konstanta Planck dan n = 1, 2, 3, . . . . (tidak nol). Bilangan bulat n yang tampak pada rumus dinamakan bilangan kuantum utama.
Selanjutnya dengan sedikit aljabar kita peroleh
Untuk menghilangkan suku v2 kita gunakan rumus gaya sentripetal:
Subtitusi nilai v2 ke dalam rumus r2 untuk memperoleh:
Besaran dalam kurung dinamakan jari-jari Borh, a0. Dengan memasukkan nilai h, m, k, e dan Z = 1, besarnya jari-jari Borh untuk atom hidrogen adalah
Dalam suku jari-jari Borh, rumus jari-jari lintasan elektron adalah
Pada rumus di atas terlihat bahwa elektron tidak dapat berada di sembarang tempat. Elektron hanya boleh berada pada lintasan-lintasan tertentu saja yang ditentukan oleh bilangan kuantum n.
Kelemahan teori atom Borh
Jika elektron bergerak dalam suatu orbit stabil melingkar mengelilingi inti dengan jari-jari r dan dengan kelajuan tetap v, maka gaya sentripetalnya sama dengan mv2/r. Karena gaya sentripetal ini diberikan oleh gaya tarik listrik, maka:
Dalam persamaan di ata, hanya r dan v yang merupakan variabel. Untuk menghitung kedua besaran, kita tuliskan persamaan di atas dalam bentuk,
Suku di sebelah kiri merupakan perkalian antara momentum elektron dan jari-jari orbit. Besaran ini dinamakan momentum sudut elektron.
Menurut mekanika Newton (klasik) jari-jari orbit suatu benda dapat mempunyai sembarangan harga. Namun postulat pertama Born menyatakan bahwa hanya orbit tertentu saja yang diijinkan. Postulat Borh dapat dipenuhi jika besaran mvr tidak mengambil sembarang nilai (kita katakan bahwa besaran mvr terkuantisasi atau momentum sudut terkuantisasi), nilai besaran ini ditentukan oleh rumus
Dengan h adalah konstanta Planck dan n = 1, 2, 3, . . . . (tidak nol). Bilangan bulat n yang tampak pada rumus dinamakan bilangan kuantum utama.
Selanjutnya dengan sedikit aljabar kita peroleh
Untuk menghilangkan suku v2 kita gunakan rumus gaya sentripetal:
Subtitusi nilai v2 ke dalam rumus r2 untuk memperoleh:
Besaran dalam kurung dinamakan jari-jari Borh, a0. Dengan memasukkan nilai h, m, k, e dan Z = 1, besarnya jari-jari Borh untuk atom hidrogen adalah
Dalam suku jari-jari Borh, rumus jari-jari lintasan elektron adalah
Pada rumus di atas terlihat bahwa elektron tidak dapat berada di sembarang tempat. Elektron hanya boleh berada pada lintasan-lintasan tertentu saja yang ditentukan oleh bilangan kuantum n.
Kelemahan teori atom Borh
- tidak dapat menerangkan spektrum dari atom yang pada kulit terluarnya lebih dari 1 elektron.
- tidak dapat menerangkan terjadinya garis spektral tambahan ketika atom hidrogen diletakkan pada medan listrik atau medan magnet
- tidak mampu menghitung besarnya panjang gelombang spektral tambahan ini, bahkan tidak meramalkan keberadaan garis ini sama sekali





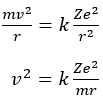
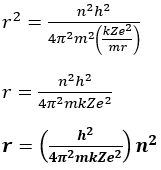

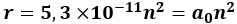
Post a Comment for "Model Atom Borh"
Sobat Fisika! Berikan Komentar di kolom komentar dengan bahasa yang sopan dan sesuai isi konten...Terimasih untuk kunjunganmu di blog ini, semoga bermanfaat!